第四章 二烯烃 共轭体系
一、二烯烃的分类和命名
1. 二烯烃的定义
分子中含有两个碳碳双键的不饱和烃,亦称双烯烃。开链二烯烃通式为 ,与同碳数炔烃互为同分异构体。
2. 二烯烃的分类
- 隔离(双键)二烯烃:两个双键被两个或两个以上单键隔开。例:
(戊-1,4-二烯)
由于两个双键相距较远,相互间影响小,其性质与单烯烃相似。 - 共轭(双键)二烯烃:两个双键被一个单键隔开。例:
(丁-1,3-二烯)
(2-甲基丁-1,3-二烯)
由于两个双键的相互影响,共轭二烯烃具有特殊性质,是本章核心讨论对象。 - 累积(双键)二烯烃:两个双键连接在同一个碳原子上,不易合成、少见,标准摩尔生成焓较高。例:
(丙二烯)
(丁-1,2-二烯)
3. 二烯烃的命名
- 与烯烃相似,选取最长碳链为母体,母体含有两个双键时命名为“某二烯”(英文后缀-diene),标明两个双键的位次。例:
(己-1,4-二烯) - 存在顺反异构时,需逐个标明双键的位次和构型(Z/E 标记)。例如:

- 丁-1,3-二烯的特殊构象:C2-C3 单键可自由旋转,存在 s-顺式(s-(Z)-丁-1,3-二烯)和 s-反式(s-(E)-丁-1,3-二烯)两种极限构象[s指单键(single bond)],但是这两种不同的空间分布是同一构型。
二、二烯烃的结构
1. 丙二烯的结构

- 杂化状态:C2 为 sp 杂化,C1 和 C3 为 杂化。
- 成键方式:C2 用两个 sp 杂化轨道分别与 C1、C3 的 杂化轨道形成 σ 键;C1、C3 用 杂化轨道与 H 形成 C-H σ 键。
- π 键特征:C2 剩余两个相互垂直的 p 轨道,分别与 C1、C3 的 p 轨道形成两个相互垂直的 π 键。
- 分子构型:线形非平面分子。
2. 丁-1,3-二烯的结构
- 杂化状态:四个碳原子均为 杂化。
- 成键方式:相邻碳原子用 杂化轨道形成 C-C σ 键,碳原子与 H 用 杂化轨道形成 C-H σ 键。
- π 键特征:每个碳原子剩余 1 个 p 轨道,垂直于分子平面且相互平行,不仅 C1-C2、C3-C4 的 p 轨道重叠,C2-C3 的 p 轨道也部分重叠,形成离域 π 键。
- 键长特征:C-C 单键键长(0.147nm)短于乙烷的 C-C 单键(0.154nm),单双键有平均化趋势。
- 分子构型:s-反式构象中所有原子共平面,键角接近 120°。
3. 丁-1,3-二烯的分子轨道
- 四个碳原子的 p 轨道线性组合成四个 π 分子轨道:(成键轨道,无节面)、(成键轨道,1 个节面)、(反键轨道,2 个节面)、(反键轨道,3 个节面)。
- 基态电子排布:四个 π 电子填充于 和 成键轨道, 和 为空轨道。

- 离域特征:成键 π 电子运动范围扩展至四个碳原子,C2-C3 间电子云密度部分增大,具有部分双键性质。
三、电子离域与共轭体系
1. 基本概念
- 电子离域:π 电子不局限于两个成键碳原子之间,扩展到多个原子范围的现象。
- 共轭分子:存在电子离域的分子。
- 共轭效应:共轭体系中电子通过离域传递外界影响的电子效应。
2. 共轭体系的类型
(1)π,π-共轭体系
- 结构特征:单双键交替排列(可含三键,组成原子可为 C、O、N、S 等)。例如:
- 性质影响:
- 键长平均化:共轭体系中单键缩短、双键增长。
- 稳定性提升:电子离域使体系能量降低,可用氢化热证明。例:
- (E)-戊-1,3-二烯(共轭体系)
氢化热:
- 戊-1,4-二烯(非共轭体系)
氢化热:
- 离域能(共轭能):两者差值 ,差值是由π电子离域引起的,是共轭效应的具体体现,通称离域能或共轭能。离域越显著,体系越稳定。
- 电荷分布:共轭链上产生正负交替电荷()。
在共轭体系中,π 电子离域可用弯箭头表示,弯箭头是从双键到形成该双键的一个原子上和 / 或单键上的,π 电子离域的方向为箭头所示方向。例如:

值得注意的是,共轭效应的发生先决条件是构成共轭体系的原子必须共平面,且其p轨道的对称轴垂直于该平面,这样p轨道才能彼此相互平行侧面重叠而发生电子离域,否则电子离域将减弱或不能发生。另外,共轭效应只存在于共轭体系中;共轭效应在共轭链上可以产生电荷正负交替现象;共轭效应的传递不因共轭链的增长而明显减弱。这些均与诱导效应不同。
(2)p,π-共轭体系
- 结构特征:π 轨道与相邻原子的 p 轨道(含未成对电子、孤对电子或空轨道)侧面重叠。
- 常见类型:
- 烯丙基自由基:未成对电子所在 p 轨道与双键 π 轨道共轭。
- 烯丙基正离子/负离子:空 p 轨道或含孤对电子的 p 轨道与双键 π 轨道共轭。
- 含杂原子的体系:如烯丙基()、氯乙烯()、乙烯基醚()。
上述几例虽均属于p,π-共轭,但其电子离域方向不完全一样,如下所示:

- 性质影响:使中间体(自由基、正离子、负离子)稳定性提升,如烯丙基自由基比普通烷基自由基稳定。
3. 共轭效应的特点
- 前提条件:构成共轭体系的原子共平面,p 轨道对称轴垂直于该平面。
- 传递特征:共轭链上电荷正负交替,传递不因链长增加而明显减弱(与诱导效应不同)。
四、共振论
1. 基本概念
- 极限结构:无法用单一经典 Lewis 结构式表示共轭体系时,用于描述电子离域限度的经典结构式(虚构)。
- 共振杂化体:多个极限结构的“叠加”,反映分子、离子或自由基的真实结构。
- 共振符号:用双头箭头“↔”连接极限结构,区别于动态平衡符号“⇌”。
- 共振能:最稳定极限结构与共振杂化体的能量差,即离域能(共轭能),共振能越大,体系越稳定。
2. 极限结构式的书写原则
- 符合价键理论和 Lewis 结构要求(如 C 不超过 4 价,第二周期元素价电子层不超过 8 电子)。
- 原子核相对位置不变,仅电子(π 电子、未共用电子对)排列不同。
- 成对电子数或未成对电子数相同。
3. 极限结构对共振杂化体的贡献规则
- 共价键数目相等的极限结构,贡献相同或相近。
- 共价键数目越多、形式电荷越少,贡献越大。
- 无电荷分离的极限结构贡献大;电荷分离且违反电负性原则(正电荷在电负性大的原子上)的极限结构,贡献可忽略。
- 键角、键长与正常值差异大的极限结构,贡献小。
4. 共振论的应用
- 解释共轭分子的结构:如丁-1,3-二烯的单双键平均化(极限结构 I:;II:;III: 共振)。
- 解释反应中间体稳定性:如烯丙基正离子的两个等价极限结构共振,使正电荷分散,稳定性提升。
- 解释反应产物:如烯烃 α-卤化的重排产物,源于烯丙型自由基的共振。
五、共轭二烯烃的化学性质
1. 亲电加成反应(1,2-加成与 1,4-加成)
(1)反应特征
- 试剂:卤素()、卤化氢(HBr)等亲电试剂,反应活性高于单烯烃。
- 两种加成方式:
- 1,2-加成:试剂加到单个双键两端(如 C1-C2 或 C3-C4),π 键断裂生成加成产物。例:
- 1,4-加成(共轭加成):试剂加到共轭体系两端(C1 和 C4),原两个 π 键消失,C2-C3 间形成新 π 键。例:
- 1,2-加成:试剂加到单个双键两端(如 C1-C2 或 C3-C4),π 键断裂生成加成产物。例:
(2)反应机理(以丁-1,3-二烯与 HBr 加成为例)
- 第一步:质子进攻 C1(生成稳定的烯丙型仲碳正离子),共轭体系电子云变形形成交替偶极
(烯丙型碳正离子的 p 轨道与 π 轨道共轭,正电荷分散于 C2 和 C4) - 第二步:Br⁻ 进攻 C2(1,2-加成)或 C4(1,4-加成)

(3)影响加成产物比例的因素
- 温度:低温(如 )有利于 1,2-加成(动力学控制,活化能低);高温(如 )有利于 1,4-加成(热力学控制,产物稳定)。
- 溶剂:溶剂极性增大,1,4-加成产物比例提高。
2. 周环反应
(1)周环反应的特点
- 协同反应:旧键断裂与新键生成同时进行,无活性中间体。
- 反应条件:受加热或光照控制,与溶剂极性、催化剂无关。
- 立体专一性:特定构型反应物在特定条件下生成特定构型产物。
(2)电环化反应
- 定义:直链共轭多烯烃分子内 π 键断裂,两端碳原子以 σ 键相连形成环状分子的反应(逆反应亦成立)。
- 反应示例(丁-1,3-二烯 → 环丁烯):
- 立体化学:
- 加热(基态):前线轨道为 ,顺旋关环(对称允许)。
- 光照(激发态):前线轨道为 ,对旋关环(对称允许)。
- 取代基影响:如 (2E,4E)-己-2,4-二烯,加热顺旋生成反-3,4-二甲基环丁烯,光照对旋生成顺-3,4-二甲基环丁烯。
(3)环加成反应
① Diels-Alder 反应(双烯合成)
- 定义:共轭二烯烃(双烯体)与含不饱和键的化合物(亲双烯体)发生顺式协同 1,4-加成,生成环状化合物的反应。
- 反应通式:
- 典型示例:
- 丁-1,3-二烯与顺丁烯二酸酐:
- 丁-1,3-二烯与丙炔醛:
- 丁-1,3-二烯与顺丁烯二酸酐:
- 反应条件:
- 双烯体需为 s-顺式构象(无空间位阻)。
- 双烯体含给电子基、亲双烯体含强吸电子基(如 -CHO、-CO₂R、-CN)时,反应易进行。
- 反应机理:前线轨道对称匹配,加热下双烯体 HOMO()与亲双烯体 LUMO(π*)或反之重叠成键,[4+2] π 电子环加成。
② 1,3-偶极环加成反应
- 定义:1,3-偶极体(3 中心 4π 电子体系,含杂原子)与亲双烯体的加成反应。
- 典型示例(乙烯臭氧化):
- 1,3-偶极体类型:臭氧、一氧化二氮、硝酮、叠氮化合物、重氮化合物等。
(4)周环反应的理论解释
- 前线轨道理论:反应关键取决于分子的最高占据轨道(HOMO)和最低未占据轨道(LUMO)的对称性匹配。
- 分子轨道对称守恒原理:反应过程中分子轨道对称性保持不变,对称允许的途径反应易进行。
3. 聚合反应与合成橡胶
(1)聚合方式
- 1,2-加成聚合:双键单独聚合,生成侧链含双键的聚合物。
- 1,4-加成聚合:共轭加成聚合,可生成顺式或反式聚合物:
- 顺式聚合:如顺-1,4-聚丁二烯(顺丁橡胶)、顺-1,4-聚异戊二烯(异戊橡胶,合成天然橡胶)。
- 反式聚合:生成反式结构聚合物。
-共聚反应:共轭二烯烃与其他不饱和化合物共聚,如丁-1,3-二烯与苯乙烯共聚生成丁苯橡胶。
例如,丁-1,3-二烯的聚合:

(2)重要聚合反应式
- 丁-1,3-二烯定向聚合(Ziegler-Natta 催化剂顺式加成聚合):
(顺-1,4-聚丁二烯)(顺丁橡胶)
- 2-甲基丁-1,3-二烯定向聚合:
(顺-1,4-聚异戊二烯)(异戊橡胶)
- 2-氯丁-1,3-二烯聚合:
(氯丁橡胶)
- 丁苯橡胶共聚:
(3)橡胶的硫化
- 线形高分子需经硫化(加热下用硫黄交联),形成网状结构,提升弹性、耐磨性和稳定性。
六、重要共轭二烯烃的工业制法
1. 丁-1,3-二烯的工业制法
(1)从裂解气 C₄ 馏分提取
- 原料:石油裂解生产乙烯、丙烯时的 馏分。
- 溶剂:乙腈、二甲基甲酰胺(DMF)、N-甲基吡咯烷-2-酮(NMP)等,其中 DMF 和 NMP 应用最广。
(2)丁烷/丁烯脱氢生产
- 脱氢反应( 催化剂,):
- 氧化脱氢法(主流):氧气将脱氢生成的 氧化为 (放热维持反应),提高转化率和选择性。
(3)物理性质
- 无色气体,沸点 ,不溶于水,溶于汽油、苯等有机溶剂。
2. 2-甲基丁-1,3-二烯(异戊二烯)的工业制法
(1)从裂解气 馏分提取
- 方法:萃取法或精馏法,萃取法应用增长。
(2)异戊烷/异戊烯脱氢生产
(3)合成法
- 异丁烯与甲醛制备:
- 异丁烯和甲醛水溶液在强酸性催化剂存在下主要生成4,4-二甲基-1,3-二𫫇烷(Ⅰ),后者在作用下受热分解生成2-甲基丁-1,3-二烯

- 丙酮与乙炔反应:
(4)物理性质
- 无色液体,沸点 ,不溶于水,易溶于汽油、苯等有机溶剂。
七、环戊二烯
1. 基本信息
- 简称:环戊二烯(环戊-1,3-二烯)。
- 物理性质:无色液体,有特殊臭味,沸点 ,相对密度 0.805,不溶于水,溶于醇、醚、丙酮、苯等有机溶剂。
- 工业来源:煤焦油蒸馏苯的头馏分、石油馏分热裂解的 馏分;实验室通过二聚环戊二烯解聚制备(二聚体加热至 分解)。
2. 化学性质
(1)双烯合成反应(Diels-Alder 反应)
- 自身二聚:一分子作双烯体,一分子作亲双烯体,生成二聚环戊二烯。
- 与亲双烯体反应:
- 与乙烯反应生成降冰片烯。
- 与丁-1,3-二烯反应生成5-乙亚基降冰片烯

(2)α-氢原子的活泼性
- 酸性:α-氢原子 pKa=16,比一般烯烃 α-氢活泼,可与活泼金属(K、Na)或强碱(NaOH)反应生成环戊二烯基负离子。

- 负离子稳定性:环戊二烯基负离子中五个碳原子均为 杂化,p 轨道共轭形成离域体系,负电荷均匀分散,具有芳香性,稳定性高。
- 二茂铁的生成:环戊二烯钾(钠)盐与氯化亚铁反应:
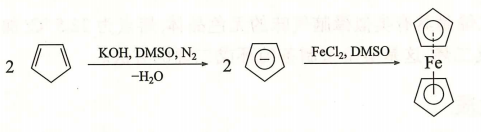
- 二茂铁性质:橙色晶体,樟脑气味,熔点 ,不溶于水,溶于有机溶剂,对热()、紫外线、酸碱稳定,用作紫外线吸收剂、火箭燃料添加剂等。
