第三章 热力学第二定律
约定:Q>0 为体系吸热;功 W 取“环境对体系做功为正”。
因此热机对外输出功的大小 Wout=−W>0。
§3.1 自发过程与不可逆性
- 自发过程:在给定条件下无需外界持续做功即可发生;其逆过程不能自动发生。
- 不可逆性来源:摩擦/黏滞、有限温差传热、自由膨胀、扩散混合、化学反应等(均伴随耗散)。
§3.2 第二定律的表述(Kelvin / Clausius)与第二类永动机
- 第二类永动机:从单一热源吸热并把热量全部转变为功且不引起其他变化——不可能实现。
- Clausius 表述:热量不可能自动从低温物体传到高温物体而不引起其他变化。
- Kelvin 表述:不可能制造一种循环热机,使其唯一结果是从单一热源吸热并把吸收的热量全部变为功。
- 两种表述等价(互相可导出)。

§3.3 热机、卡诺循环与卡诺定理
1)热机效率
- 热机:从高温热源 Th 吸热 Qh,向低温热源 Tl 放热 Ql,对外输出功 Wout。
- 循环过程 ΔU=0,能量关系:
Wout=Qh+Ql(Ql<0)
η=QhWout=1+QhQl(0<η<1,Ql<0)
2)卡诺循环(两等温 + 两绝热,可逆)
- 卡诺循环由 2 个可逆等温过程与 2 个可逆绝热过程组成,是理想可逆热机的基准。
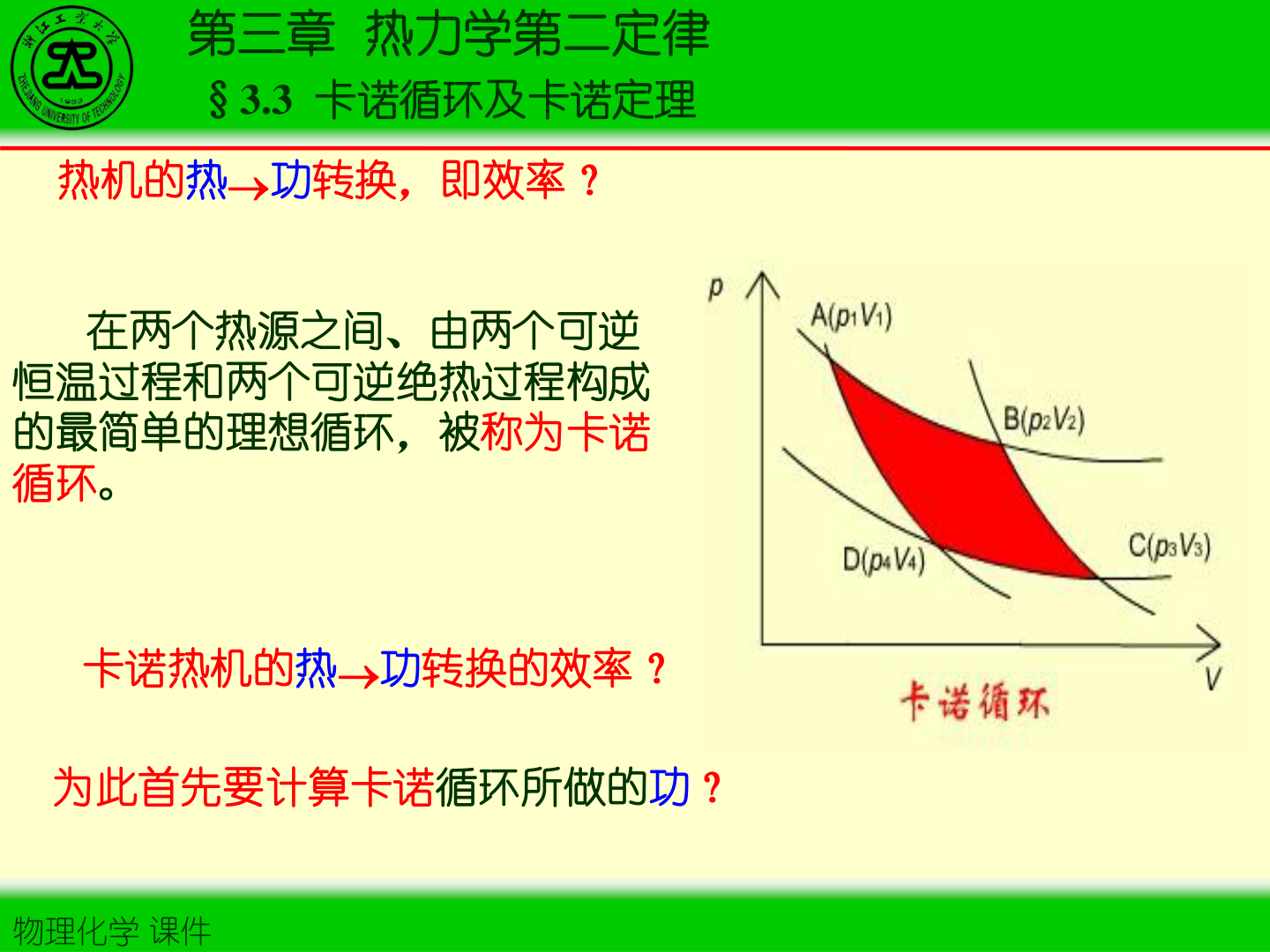
3)卡诺效率与卡诺定理
ηR=1−ThTl
- 卡诺定理:
任意两热源间:可逆热机效率最大;同一对热源间:所有可逆热机效率相同;不可逆热机 η<ηR。
§3.4 热力学温标(绝对温标的建立)
ThQh+TlQl=0
∣Ql∣Qh=TlTh
§3.5 克劳修斯不等式与熵的引入
1)克劳修斯不等式
∮TδQ≤0

2)熵(状态函数)
dS=TδQrev
dS≥TδQ

3)熵增原理
ΔSiso≥0
ΔSuniv=ΔSsys+ΔSsurr≥0
ΔSsurr=−TQsys
§3.6 常用熵变计算模板(只列公式)
1)相变熵
ΔStr=TtrΔHtr
2)理想气体熵变(Cp,m,CV,m 近似常数)
ΔS=nCV,mlnT1T2+nRlnV1V2
ΔS=nCp,mlnT1T2−nRlnp1p2

3)混合熵(理想混合)
ΔSmix=−Ri∑nilnxi
4)反应熵
ΔrS=i∑νiSm,i,ΔrS∘=i∑νiSm,i∘
§3.7 第三定律与绝对熵
- 第三定律(Planck):T→0 时完全晶体 S(0)=0(规定熵零点)。
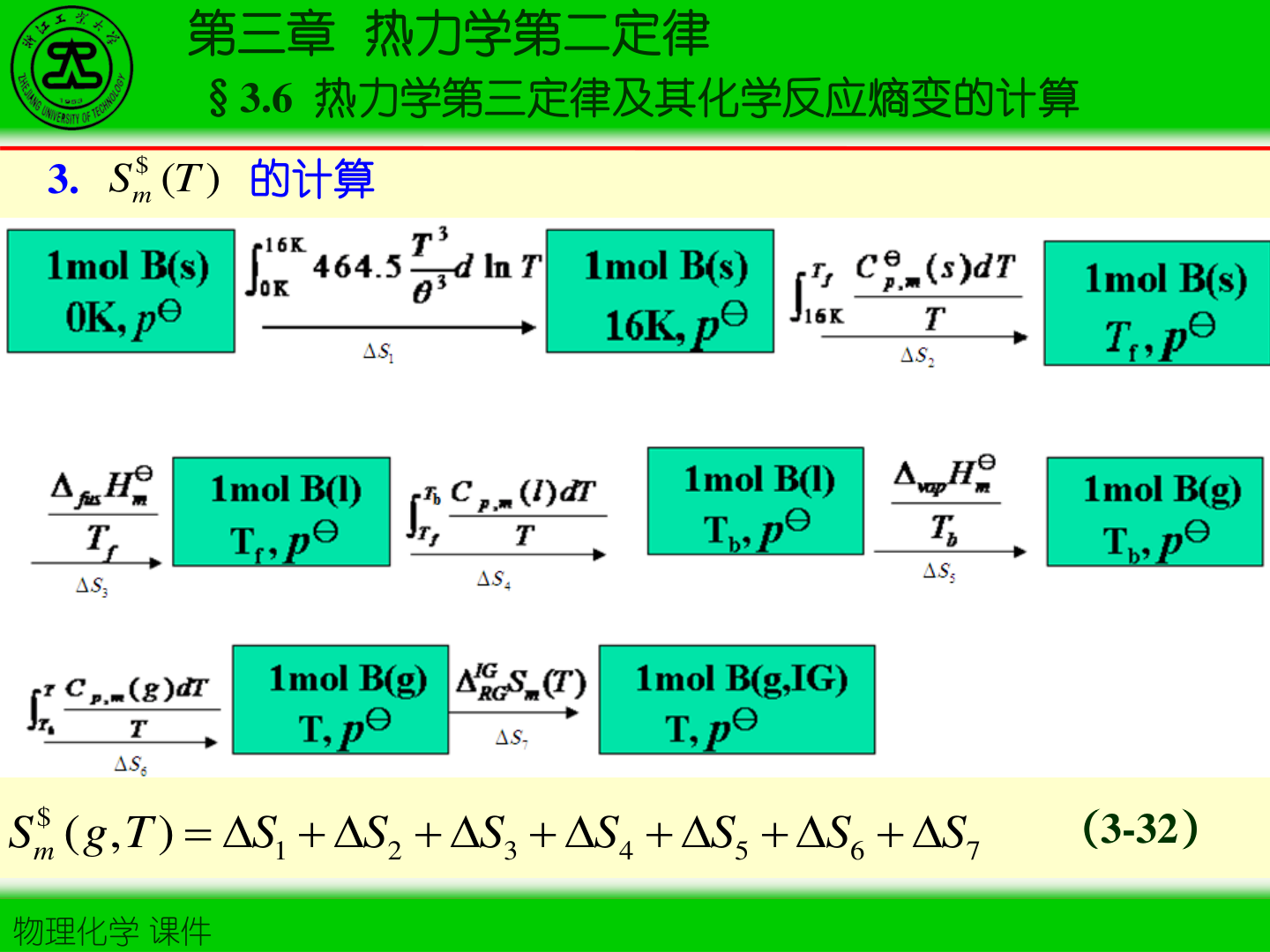
- 绝对熵计算框架(分段积分 + 相变项):
Sm(T)=∫0TTCp,mdT+k∑Ttr,kΔHtr,k
§3.8 自由能函数与自发判据(A/G)
1)定义
A=U−TS,G=H−TS
2)微分式(闭系、仅 pV 功)
dA=−SdT−pdV
dG=−SdT+Vdp
3)“最小值原理”(判据)
ΔA≤0(自发),ΔA=0(平衡)
ΔG≤0(自发),ΔG=0(平衡)

§3.9 Maxwell 关系与 Gibbs–Helmholtz
1)Maxwell 关系(示例两条)
(∂V∂S)T=(∂T∂p)V
(∂p∂S)T=−(∂T∂V)p

2)Gibbs–Helmholtz
(∂T∂(G/T))p=−T2H
对反应量:
(∂T∂(ΔrG∘/T))p=−T2ΔrH∘

§3.10 ΔG、平衡常数与温度影响
ΔrG=ΔrG∘+RTlnQ
- 平衡:ΔrG=0,得:
K=exp(−RTΔrG∘)
dTdlnK=RT2ΔrH∘









